再度、嗅覚について書きます。
今回は嗅覚受容体と遺伝子についてです。
匂い分子
嗅覚受容体について書く前に、匂いとは何かについて復習しましょう。
匂い分子は、分子量300以下の揮発性低分子化合物です。分子量が300以下ということがどんなに小さな物質か、化学の知識がある方は実感されると思います。300以下の物質なので揮発して空気中を浮遊する物質となるのです。
空気中を浮遊する匂い分子が鼻腔に吸い込まれ、鼻腔天蓋の嗅上皮(図1の4)に付着することから嗅覚の応答は始まります。
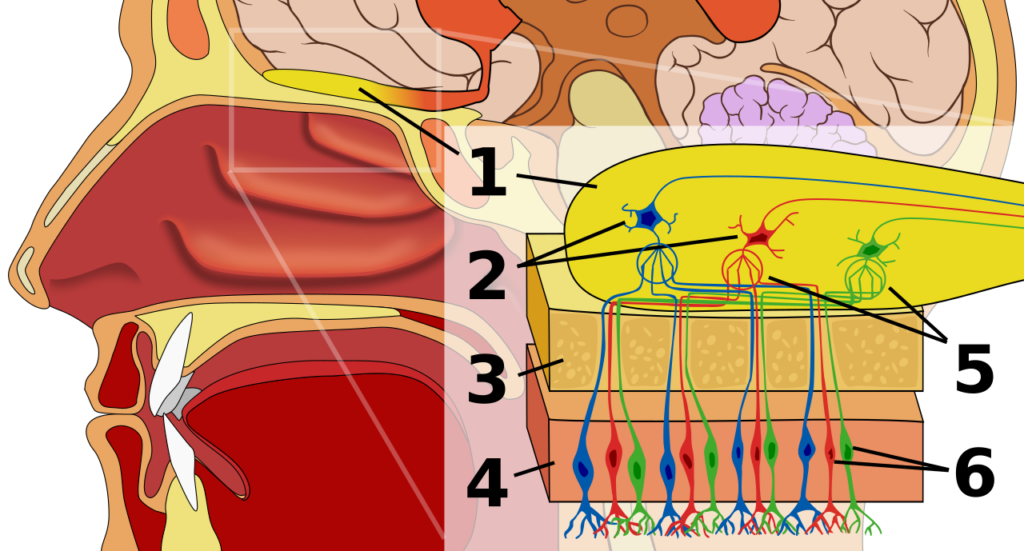
- 嗅球
- 僧帽細胞
- 骨(篩骨の篩板)
- 鼻粘膜上皮
- 嗅糸球
- 嗅覚受容細胞
https://ja.m.wikipedia.org/wiki/%E5%97%85%E8%A6%9A
嗅覚受容体
1991年、Linda BuckとRichard Axelによって嗅覚受容体候補遺伝子の単離が成功しました。以降、嗅覚受容体の存在が知られるようになりました。
嗅覚受容体はヒト鼻腔の嗅粘膜に存在し、匂い分子に反応する受容体です。匂い分子は、分子量300以下の揮発性低分子化合物ですが、これに対応する嗅覚受容体は、Gタンパク共益受容体(G protein-coupled receptor, GPCR)と呼ばれる生体内で最も多いタイプの受容体です。Gタンパク共益受容体は、細胞膜を7回貫通する特徴的な構造を有する受容体なので、7回膜貫通型受容体と呼ばれることもあります。(図2)
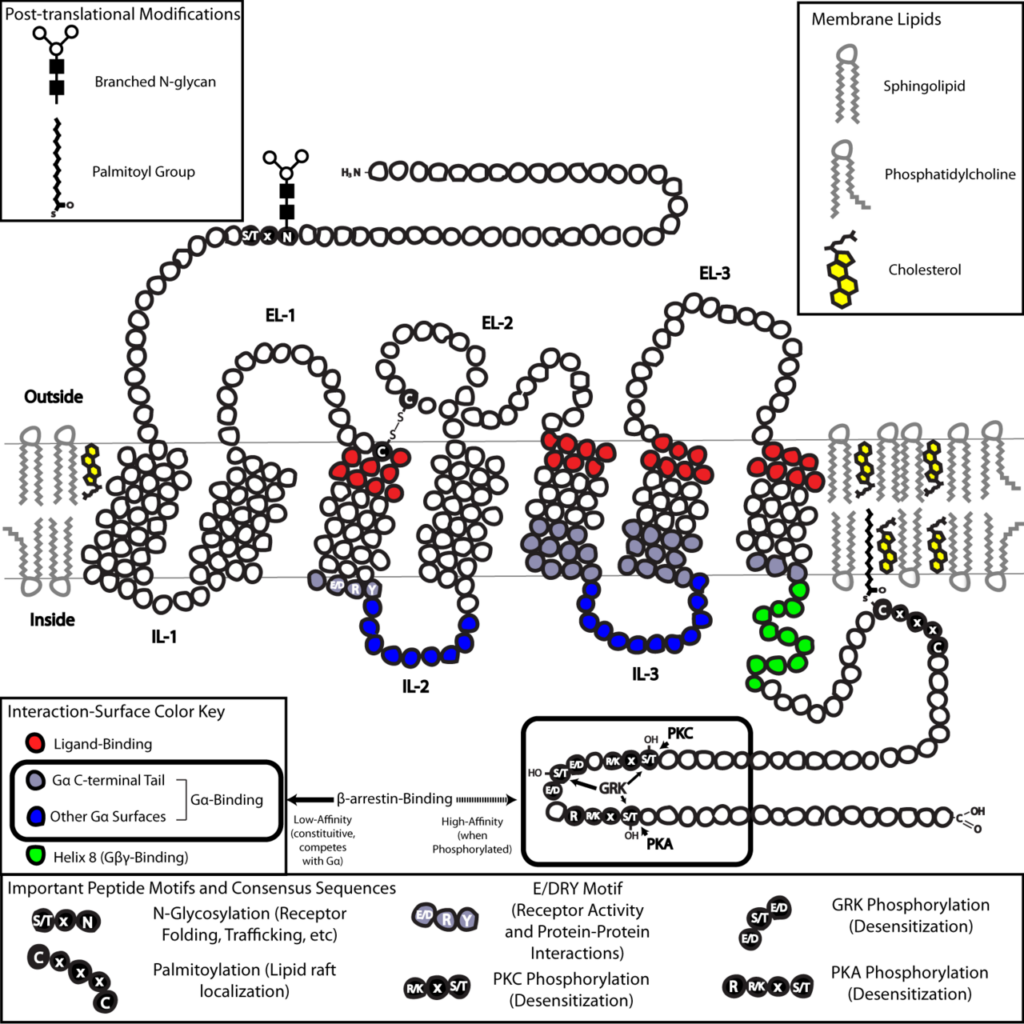
生体内のGタンパク共益受容体は、アセチルコリン受容体、アデノシン受容体、アドレナリン受容体、GABA受容体、アンギオテンシン受容体、グルカゴン受容体、ドーパミン受容体、ヒスタミン受容体など、その他多数あります。
嗅覚受容体の発見は比較的新しく、2004年にLinda BuckとRichard Axelは、嗅覚受容体の研究によってノーベル生理学医学賞を受賞しています。
GPCRの構造をもつ嗅覚受容体は、匂い分子の構造へ結合します。匂い分子が嗅覚受容体へ結合すると、細胞内のGタンパク質が活性化されて、アデニル酸シクラーゼを活性してATPを環状AMP(cAMP)へ変換します。
cAMPはイオンチャネルを開き、ナトリウムイオンが細胞内へ入ります。
細胞に脱分極が起きて、その活動電位が脳へ送られます。
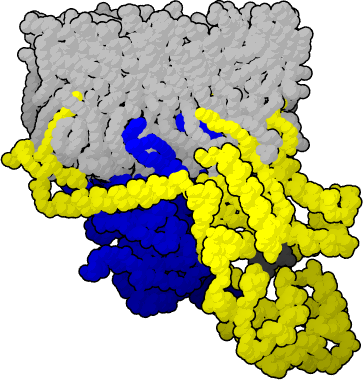
黒色GDP, 黄色αサブユニット,
青色βγサブユニット
嗅覚受容体に匂い分子が結合すると、細胞内にあるGタンパク質のαサブユニットのGDPがGTPになり、Gタンパク質が活性化されます。Gタンパク質が活性化されると、アデニル酸シクラーゼが活性化され、cAMP経路が活性化されて細胞膜のイオンチャンネルが開き、Na+ イオンが細胞内に流入して嗅覚受容体細胞に活動電位が発生します。
嗅覚受容体から嗅細胞へ
嗅覚受容体が匂い分子の一部と結合して活動電位を発生し、嗅覚の反応が開始することが理解できました。
嗅覚受容体の電気信号は、同じ嗅上皮内にある嗅細胞へと伝達されます。
嗅細胞(嗅覚受容細胞)は、双極細胞です。
すなわち、嗅細胞の両端から樹状突起(dendrite)と軸索が出現して2方向に伸び、樹状突起は鼻腔側へ、軸索は嗅神経の嗅球へ繋がっています。
再度、図1を確認してください。図1の6が嗅覚受容細胞(嗅細胞)です。鼻腔天蓋方向の1本の樹状突起先端から10-20本の嗅繊毛が伸びて、その先に嗅覚受容体があります。
嗅繊毛は直径0.2μm、ダイニン(モータータンパク)を欠くため不動毛です。
嗅上皮には嗅細胞のほかに支持細胞、基底細胞があり、嗅細胞はその間に挟まれて存在しています。ヒトの嗅上皮の広さは10 cm2 で、ボウマン腺を有していて、嗅上皮を粘液層で覆っています。
匂い分子は、吸気とともに鼻腔天蓋に入り、嗅上皮を覆っている粘液層に溶け込みます。その後、嗅細胞の樹状突起から伸びている嗅繊毛上に発現している嗅覚受容体に結合することになります。
Gタンパク共益受容体である嗅覚受容体(図1)に結合した匂い分子のリガンドが、Gタンパク質を活性化させて(図3)、嗅覚受容体に活動電位が発生するのです。
この電位が嗅覚信号になります。
反対側へ向かう軸索は、嗅神経先端(1)の嗅糸球5(糸球体)に繋がっています。
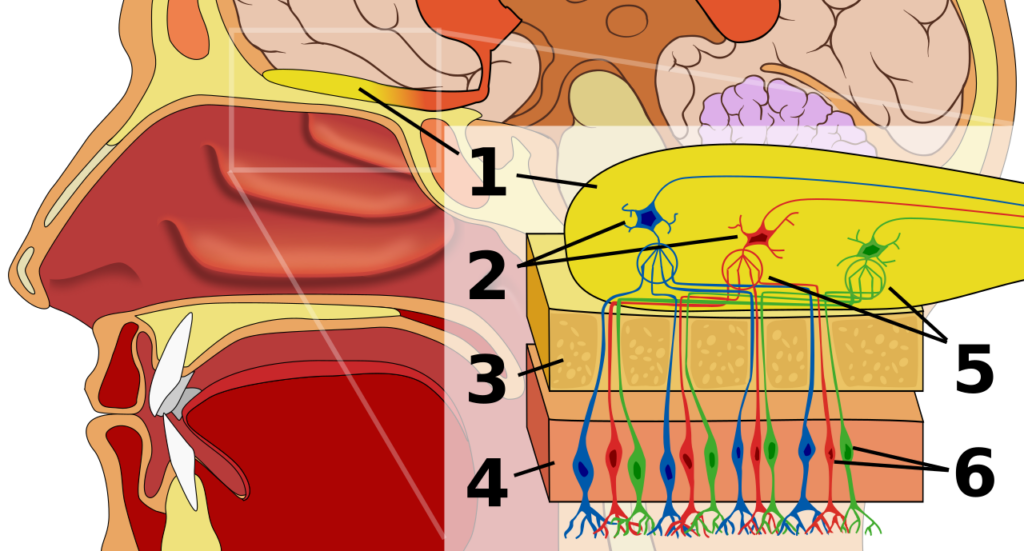
1 嗅球
2 僧帽細胞
3 骨(篩骨の篩板)
4 鼻粘膜上皮
5 嗅糸球
6 嗅覚受容細胞
ヒトは396個の嗅覚受容体を持っています。
1つの嗅細胞は、鼻腔側の樹状突起上に存在する繊毛の細胞膜上に、たった1種類の嗅覚受容体を発現しています。
1つの嗅細胞に1つの嗅覚受容体が存在します。
(1細胞-1受容体ルール)
鼻腔天蓋側の嗅上皮には、4000万個の嗅細胞が存在しますので、嗅覚受容体396個を400として計算すると、1種類の同じ嗅覚受容体をもつ嗅細胞は、受容体ごとに10万個存在することになります。同じ受容体をもつ嗅細胞の軸索はつまり、400種類の嗅覚受容体をもつ嗅細胞が10万個ずつ束になって存在する、と理解してください。
もう1つ特徴があります。同一の嗅覚受容体をもつ嗅細胞からの軸索は、すべて嗅神経の同じ嗅糸球(糸球体)につながっています。(図1の5)
(1受容体-1糸球体ルール)
図1の青色、赤色、緑色の神経軸索が、複数の違う嗅覚受容体から同じ嗅糸球に集まっているのが確認できると思います。(青色→青色、赤色→赤色)
嗅覚受容体の数が396個ならば、ヒトは396種類の匂いしか嗅ぎ分けることができないのでしょうか。そうではありません。
前回書いた記事にありますが、(嗅覚 -その1-) 匂い分子は嗅覚受容体と1対1で結合するのではありません。
①1つの匂い分子は、複数の違う嗅覚受容体と結合します。
②1つの嗅覚受容体は、複数の違う匂い分子に結合します。
したがって嗅覚受容体と匂い分子の結合パターンは複数×複数となります。
その結合パターンは、1種類の匂い分子ごとにすべて違うため、嗅覚受容体は396種類であっても、匂い分子の組み合わせはほとんど無限に近い種類の匂いを分別することが可能になります。
実際の匂い分子は自然界に200万種類存在すると言われています。この中で数個に1つが匂いとして感知できるのではないかと言われています。
先に書いたように、嗅覚の応答が始まるためには、匂い分子が嗅上皮の粘液層に溶け込まなければなりません。したがって水溶性(水に溶けやすい)の匂い分子は嗅覚受容体に高濃度で結合しやすく、逆に不溶性または難容性の匂い分子は嗅覚受容体に結合しにくいか、低濃度で結合することになります。
匂い分子が水溶性か不溶性か(親水性か疎水性)によって、嗅覚受容体の入力が違ってしまうのです。
自然界に存在する匂い分子のすべてが匂いとして感知できないのは、このような理由も1つあります。
嗅細胞は体内にある神経細胞と違い、直接外界に触れて有害な化学物質などに曝露されやすい環境にあり、ウイルス感染などによって容易に細胞がダメージを受けやすくなっています。そのため嗅細胞は、定期的に基底細胞が分化して新しい嗅細胞に置き換わることが知られています。これが嗅細胞の再生です。
嗅糸球体と僧帽細胞
396種類の嗅覚受容体からの電気信号が嗅神経先端の嗅球に存在する嗅糸球体に入力されてきます。(図1の5)
先に書いたように、同じ嗅覚受容体からの軸索だけが同じ嗅糸球体に集合するため、原理的には396個の嗅糸球体が存在するはずです。
嗅球の嗅糸球体の周辺には、僧帽細胞と房飾細胞が存在しています。その働きは未だよく解明されていないことが多くありますが、僧帽細胞と房飾細胞は、多数の嗅糸球体と樹状突起で連絡しており、嗅球の嗅神経軸索から大脳の嗅皮質へ電気信号を送るためのいわば最終調整を行う部位だと考えられています。
1つの嗅糸球体は20-40個の僧帽細胞と樹状突起で繋がっていて、僧帽細胞は嗅覚入力の強度の調整、いわば嗅覚入力のチューニングを行っているという仮説が提唱されています。
嗅糸球体と僧帽細胞、房飾細胞との間で嗅覚のネットワークが形成され、嗅球の”匂い地図”と呼ばれる神経投射部位の存在が推測されているようです。
この僧帽細胞から嗅皮質へ電気信号が送られて初めて嗅覚として感知すると考えられています。
嗅覚受容体遺伝子
ヒトの嗅覚受容体は396種類あることが理解できました。その受容体で数10万種類の匂いを嗅ぎ分けることができることも。
これら嗅覚受容体は、どのようにして「発現」しているのでしょうか。発現とは嗅細胞上に受容体が現れることを言います。
生体内での受容体発現は、すべて遺伝子のコントロール下に行われています。嗅覚受容体を発現している「嗅覚受容体遺伝子」について、理解が必要になってきます。
遺伝子とDNA
遺伝学についての基礎知識がないと、嗅覚と遺伝子の関係は理解困難です。
まず、遺伝子について高校での生物から復習しましょう。
遺伝子に関する説明は代表的なテキストやweb上にも多くありますが、その中でもwikipedia による図やイラスト、説明文が非常に優れており、専門的な知識を理解しやすいため、以下の部分はwikipedia からの引用を中心に構成しました。
ヒトの遺伝子はDNAから生成されます。
DNAはデオキシリボ核酸(deoxyribonucleic acid)と呼ばれる核酸の一種です。
核酸(nucleic acid)は、塩基、糖、リン酸で構成されるヌクレオチドが結合した高分子です。
核酸には、デオキシリボ核酸(DNA, deoxyribonucleic acid)とリボ核酸 (RNA, ribonucleic acid)があります。
核酸を構成する糖がデオキシリボースであるものがDNA、リボースであるものがRNAです。
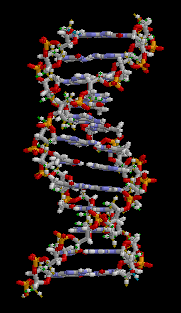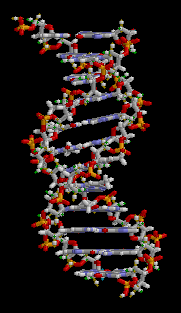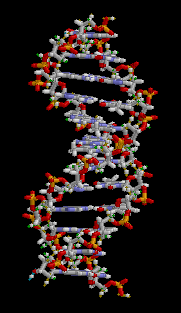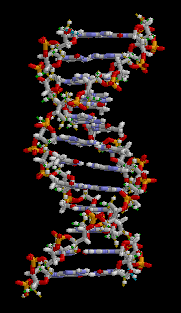
ヒトのDNAは4種類の塩基配列(アデニン: A、チミン: T、グアニン: G、シトシン: C)を繰り返しながららせん構造をとって並んでいます。
2本のDNA鎖は、塩基のAとT、GとCが対を作って右巻きのらせん構造を形成しています。
これをDNAの2重らせんと言います。(図4)
A(adenine)-T (thymine)
G (guanine)-C (cytosine)
の塩基の組み合わせは、対になる2重らせんDNAどうしで水素結合で繋がっていて、塩基対と呼ばれます。(図4)
ヒトのDNAは、32億塩基対あると言われています。この32億の塩基対が存在する長いDNAが、ヒストンというタンパク質に結合して小さく折り畳まれ、染色体として核内に収納されます。
T (thymine)はRNA中ではU (uracil, ウラシル)に置き換わります。
DNAは生物の遺伝情報の保存と発現を担う高分子物質です。
DNAは遺伝情報を伝達するために、複製、転写、翻訳の3つの過程をとっています。
ヒトの体細胞1個に含まれるDNAの長さは2 m と言われています。
複製
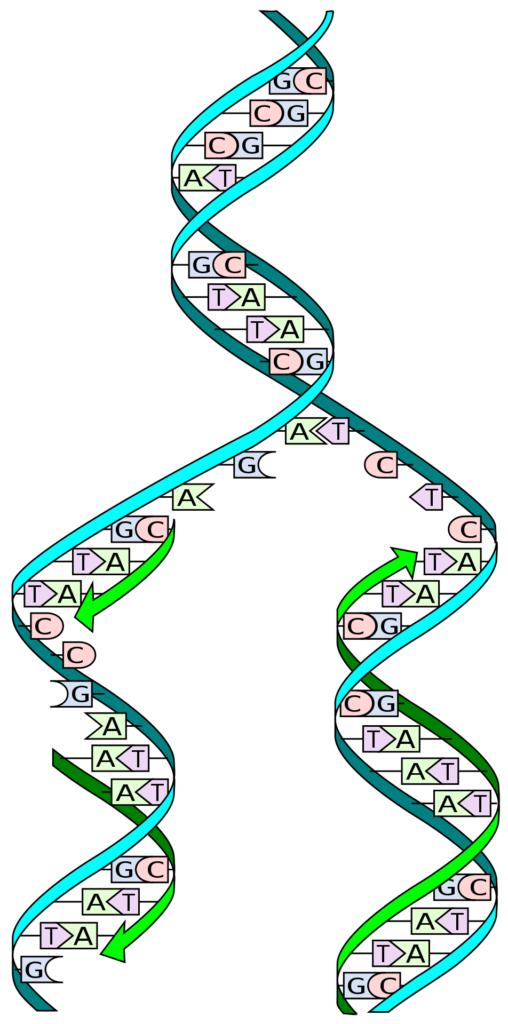
https://ja.m.wikipedia.org/wiki/DNA%E8%A4%87%E8%A3%BD
DNAの複製は、2本鎖のDNAがほどけて、ほどけた部分の塩基対に対応する塩基配列をもったDNA鎖が新しく構成されます。(図5)
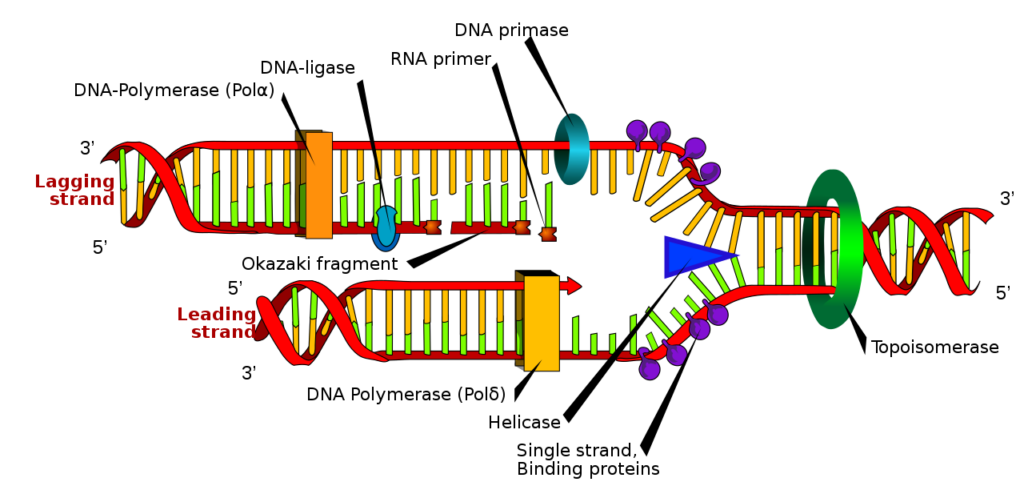
青い三角Helicase 🟦が2本鎖DNAを1本鎖に解きます。緑の環、Topoisomerase 🟩がDNAの捩れを直し、紫のsingle strand binding protein (ss BP) 🟪が2本鎖の再結合を防ぎ、水色環のDNA primase が親鎖に、RNA primer 🟧が配置されます。黄色のDNA polymerase 🟨が、primer の3’ 末端側からDNAを複製します。複製は2本で違い、上のラインはラギング(lagging)鎖、下のラインはリーディング(leading)鎖と呼ばれ、複製方向が逆方向です。ラギング鎖は岡崎(Okazaki)フラグメントと呼ばれる短い複製鎖を繰り返し継ぎ足して複製作業を進めていきます。
リーディング鎖とラギング鎖でそれぞれ複製されたDNA鎖は再び2重らせん構造に戻り、2本鎖DNAを形成します。
これでDNAの複製は完了します。
じつはこの部分はもうすこし複雑で奥が深いのですが、これ以上の知識は嗅覚受容体遺伝子の理解に必要ありませんので、省略します。
ご興味のある方はご自分で調べてみてください。
転写
転写とは、DNAの特定の部位の塩基配列から遺伝情報を読み取る過程です。この遺伝情報がこの後のすべてのタンパク質合成を決定しますので、非常に重要な工程になります。
転写では、DNA鎖が一部分ほどけて、対の塩基配列をなすRNAが作られます。
このRNAを元にタンパク質を合成しますので、RNAはDNAの鋳型になります。
このとき、A-T、G-Cの組み合わせで、対になる塩基配列は常に1つに決定されますので、DNAの転写部位からは常に決まった1つの鋳型が完成します。
形成される 鋳型RNAは、messenger RNA (m-RNA) と呼ばれます。
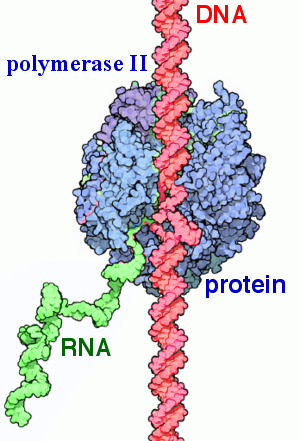
https://ja.m.wikipedia.org/wiki/RNA%E3%83%9D%E3%83%AA%E3%83%A1%E3%83%A9%E3%83%BC%E3%82%BCII
2本鎖DNA(ピンク色)にRNA polymerase Ⅱ (青色)がくっついて転写を開始し、RNA(緑色)を作り出します。(図6)
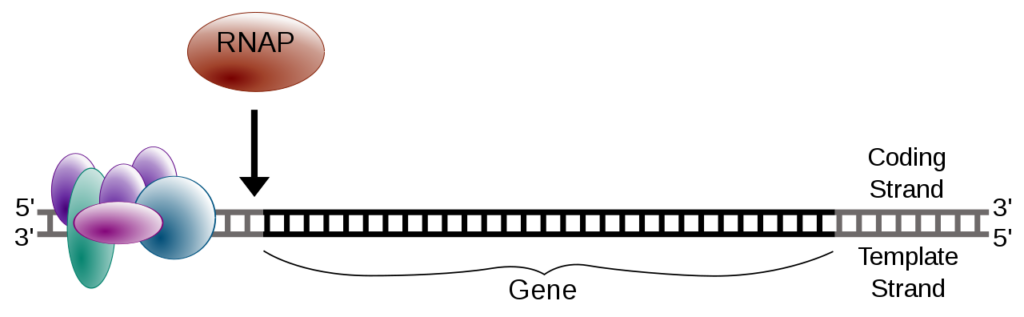
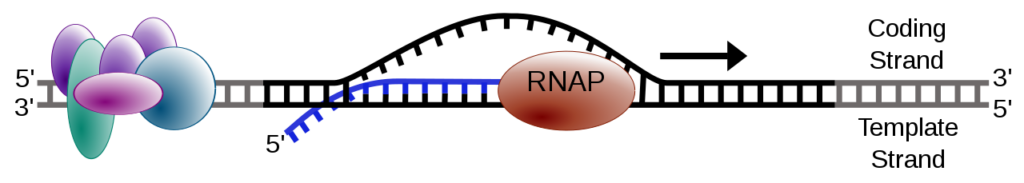
https://ja.m.wikipedia.org/wiki/%E8%BB%A2%E5%86%99_(%E7%94%9F%E7%89%A9%E5%AD%A6)
これを模式図で示すと、2本鎖DNA(黒色)の転写開始位置(プロモーター)に複数の転写因子(紫色、水色、緑色)が接着した後、RNAP(RNA polymerase, 茶色)が接着して、鋳型DNAの転写が開始されます。
転写された鋳型DNAは pre-m RNA (m RNA前駆体)となり(濃い青色🟦)、2本鎖DNAから分離されます。(図7)
pre-m RNA は、核から細胞質に移動してスプライシング(切断)を受け、成熟m RNA が形成されます。
スプライシング
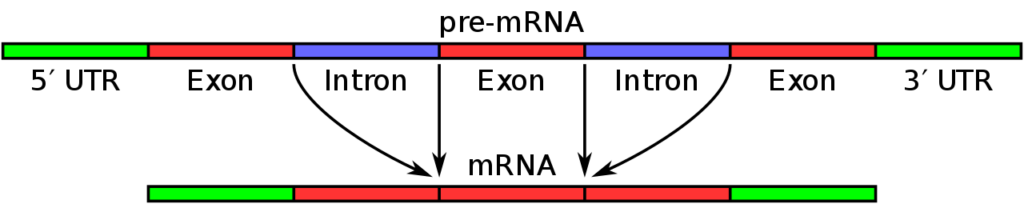
DNA全長の塩基配列には、遺伝情報をもつ(コードしている)配列と遺伝情報を持たない(コードしていない)配列が混在して並んでいます。
遺伝情報がコードされている配列は、タンパク質合成を行うことができる遺伝子領域であり、遺伝情報がコードされていない配列は、タンパク質合成を行うことができません。
したがって遺伝子には、タンパク質合成をコードしている塩基配列が「飛び石状に」「分断して」存在します。
そのためDNAの遺伝情報を、遺伝子から鋳型の形で読み取ったmessenger RNA (m-RNA) にも、タンパク質合成を行う部分と行わない部分が混在して存在します。
遺伝子鋳型DNAのm RNA で、前者の部分をエクソン(exon)、後者をイントロン(intron) と言います。
mRNAが核内から出て細胞質に移った後、タンパク質合成を行わない領域(イントロン)が切断されて再度繋ぎ合わされます。
これをスプライシング(splicing)と言います。
イントロンと呼ばれるタンパク質合成をコードしない部分が何故DNA上の塩基配列に存在していて、わざわざ切断と再結合(スプライシング)を行なって、m RNA を作り変えているのでしょうか。
この問いに対して、現在確認されているのは、選択的スプライシングとエクソンシャッフリング仮説です。
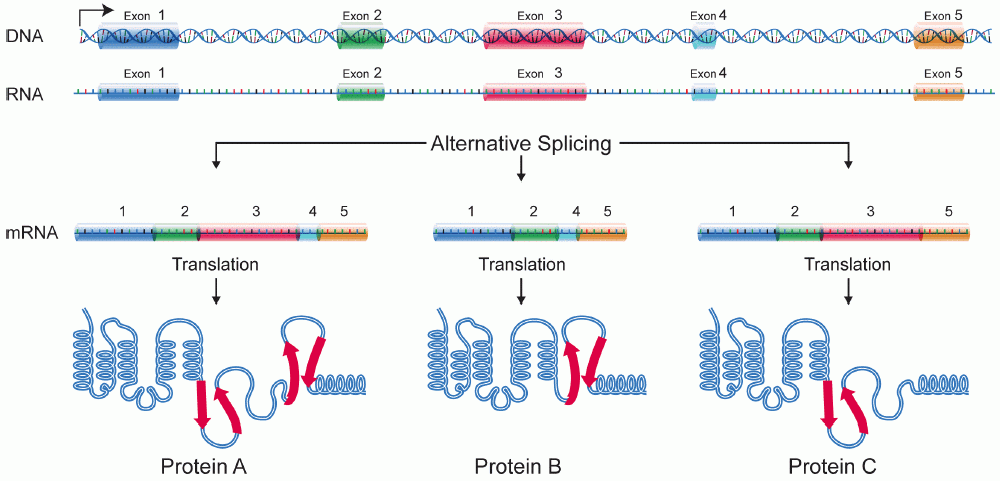
選択的スプライシングは、スプライシング時に特定のエクソンが選択的にスキップされ(省略され)ることで、1つのm RNA 前駆体から複数種類の成熟m RNA が生成される現象です。
選択的スプライシングによって、1つの遺伝子から複数のタンパク質を生成することが可能になります。
https://ja.m.wikipedia.org/wiki/%E3%82%A4%E3%83%B3%E3%83%88%E3%83%AD%E3%83%B3
図10で、exon1-5が繋がった全長をもつm RNA から翻訳されて合成されるタンパク質 protein A、exon3 をスキップしたm RNA から翻訳されるprotein B、exon4 をスキップしたm RNAから翻訳されるprotein C 。1つのm RNA から複数のprotein(タンパク質)が合成されます。
選択的スプライシングは、生体のタンパク質の多様性を大きく変化させる結果につながります。
ヒトでは、複数のエクソンからなる遺伝子のうち約95%が選択的スプライシングを受けると言われています。
現在提唱されている学説に「エクソンシャッフリング仮説」があります。
これは、エクソンを繋ぎ合わせるときに「エクソンの組み合わせの変化が起こって新たな遺伝子が作られることがあり、これが生物の進化に重要な役割を担っている」という理論です。
その他にイントロンにはm RNA 前駆体を核内から細胞質は移動させる働きもあると言われています。
スプライシングは、DNA鎖本体に行なわれることはなく、常に転写されたm RNAに対して行なわれます。
修飾
m RNAは、転写開始直後から先端にキャップ形成(capping)を受け、転写終了直後に末端にポリアデニル化(poly A鎖 付加)が行なわれます。
ポリアデニル化は、mRNA末端にpoly A 鎖を付加することにより、選択的スプライシング時と同様に複数のm RNAを生成することに役立っています。
m RNAに対してこれらの修飾が行われることによって、m RNAはキャップ認識による核外輸送の促進、細胞内での分解抑制、翻訳、選択的スプライシングによる複数のm RNA生成などが可能になります。
修飾は細胞内でのm RNAの安定に役立っています。
翻訳
翻訳(Translation)とは、mRNAの塩基配列からタンパク質を合成する反応です。
mRNA前駆体は、核を出て細胞質内に移動した後、スプライシングを受けてm RNAになります。
m RNAに細胞質に存在するリボゾーム(ribosome)が結合すると、タンパク質合成が始まります。
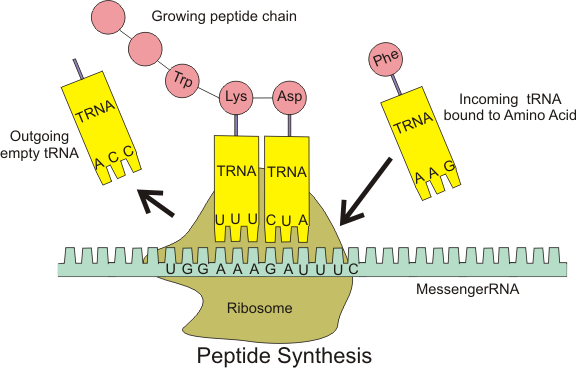
https://ja.m.wikipedia.org/wiki/%E8%BB%A2%E7%A7%BBRNA
Ribosome(リボゾーム)が読み取る、messenger RNA (m RNA)上の3つの連続した塩基配列(=コドン、codon)には、transfer RNA (t- RNA)のアンチコドン(anti-codon)が1対1対応しています。(図11)
コドンとは、m RNA上の塩基配列がタンパク質を構成するアミノ酸へ翻訳されるとき、連続する3つの塩基配列がある特定のアミノ酸に対応する関係が存在します。
AAA-UUU、GAU-CUA等。(図11)
この連続した3つの塩基配列をコドンと言います。
m RNAの3つの連続する塩基配列が、(遺伝情報として)1個のアミノ酸を特定します。
コドンのパターンによって結合するアミノ酸が違います。t RNAは、そのアミノ酸への橋渡しのような働きをしています。

https://upload.wikimedia.org/wikipedia/commons/9/94/Protein_translation.gif (引用)
リボゾームは大ユニットと小ユニットの2つのサブユニットから構成されています。mRNA(黒い線)をリボゾーム(薄い黄色、薄い黄緑色)が挟み込むように結合して、1方向に移動して、m RNA の遺伝情報を読み取っていきます。m RNAのコドンに対応しているt-RNA(濃い青色)が遊離しているアミノ酸を運んできます。
翻訳は、mRNAの3つの連続した塩基配列(codon)に対応する、t-RNAの塩基配列(anticodon)を繋ぎ合わせて行われていきます。
タンパク質はポリペプチド(poly peptides)であり、ペプチド(peptide)が多数繋がった形をしています。ペプチドは多数のアミノ酸が繋がった形をしていますが、このアミノ酸を決まった位置に並べていくのがt RNAの機能です。
codonとanticodon が結合してt-RNAに結合していたアミノ酸をポリペプチド鎖に繋ぎ合わせ、この作業を繰り返しながら長いポリペプチド鎖(タンパク質)合成を進めていきます。
(図12 アニメーション)
ヒトのタンパク質構成要素としてのアミノ酸は20種類です。1つの塩基配列はA, U, G, Cの4種類しかありませんので、すべてのアミノ酸を表現するには2列の4×4種類でも不足しています。3列の塩基配列=4×4×4(64種類)による識別が必要になります。
t RNAの種類はアンチコドンの数と正確に一致してはいないため、違うアンチコドンをもつt RNAが同じアミノ酸を誘導する場合があります。
2本鎖DNAのうち、遺伝子として遺伝情報を伝える部分は僅か1.5%に過ぎません。残りの98.5%のDNA鎖は、遺伝子のコントロールに役立っているとされています。
嗅覚受容体の発現
生体内のすべての細胞内にDNAが存在しており、すべての核内でDNAの複製、DNAからm RNAへの転写が行われ、すべての細胞質内でmRNAのスプライシング、m RNAからのタンパク質合成が進みます。
したがって、嗅細胞も核の中にDNAが存在しますので、嗅細胞の核内でm RNA への転写が起こり、嗅細胞の細胞質でm RNAからのタンパク質合成が進みます。
したがって嗅覚受容体の遺伝情報をもつDNAは、嗅細胞の核にあるDNAから転写、翻訳の過程を経て、嗅細胞の細胞質内で嗅覚受容体タンパクを合成します。これが嗅細胞の樹状突起から伸びた嗅繊毛上の細胞壁に、Gタンパク共益受容体(GPCR)として発現します。
このようにして、嗅覚受容体が発現します。
嗅覚受容体を発現する遺伝子をもったDNAからmRNAとして遺伝情報が転写され、mRNAからタンパク質(嗅覚受容体)に翻訳されて、細胞膜に発現する過程が理解できました。
複数の遺伝子
ヒトDNA全長の塩基配列は32億塩基対です。この32億塩基対のうち「タンパク質の設計図の部分」を「遺伝子」と言います。
ヒトDNAには23000個の「遺伝子」があります。すなわち、ヒトのDNA全長の中には、生体に必要な23000個の違うタンパク質を合成するための「設計図の部分」があり、この1つ1つを「遺伝子」と呼んでいるのです。
原則的に、1遺伝子は遺伝情報から1タンパク質を合成して発現します。
23000個の遺伝子から23000種類のタンパク質が合成されて発現することになります。
生体内には10万種類の違うタンパク質が存在しています。DNA転写時にm RNAの選択的スプライシングによって1遺伝子から複数のタンパク質合成が可能になるため(図10)、23000遺伝子から合成されるタンパク質は10万種類くらいになると考えられます。
嗅覚受容体は「細胞膜上に存在する7回膜貫通型のGタンパク質共益受容体」(図2)であり、生体内のタンパク質です。
基本的に1遺伝子から作られた1タンパク質が1受容体として発現します。
ヒトの嗅覚受容体は396種類あります。
嗅繊毛の細胞膜上に発現する1種類の嗅覚受容体を作る遺伝子は23000個ある遺伝子のうち1つです。
したがって396種類の違う嗅覚受容体を細胞膜に発現するには、396個の違う遺伝子が必要なのです。
嗅覚受容体遺伝子
嗅覚受容体を発現する遺伝情報をもった遺伝子を、嗅覚受容体遺伝子と呼びます。
ヒトの嗅覚受容体遺伝子には、いくつかの特徴があります。
ヒトを含む哺乳類の遺伝子の総数は、20000-25000と言われています。
BuckとAxelは、ラットの嗅覚受容体遺伝子の数を約1000個と報告しました。
現在ではマウス、ラット、サル、ヒトから大型哺乳類のウシ、ウマ、ゾウまで、13種類の有胎盤類がもつ嗅覚受容体遺伝子(機能遺伝子)数が報告されています。(Niimura et al, 2014, 東京大学) (図9)
図9では、機能遺伝子を赤色(🟥)、偽遺伝子を青色(🟦)で表現しています。
偽遺伝子は、進化の過程で突然変異によってタンパク質を生成しなくなった遺伝子のことです。このような遺伝子もDNA上に残っていて、偽遺伝子と呼ばれています。実際にタンパク質合成を行なっているのが機能遺伝子です。
この論文では機能遺伝子(🟥)が、アフリカゾウ1948個、ラット1207個、ヒト396個、チンパンジー380個となっています。
哺乳類の遺伝子総数は20000-25000ですので、嗅覚受容体遺伝子は機能遺伝子だけでも、このうち最大10%も占めている計算になります。(アフリカゾウ)
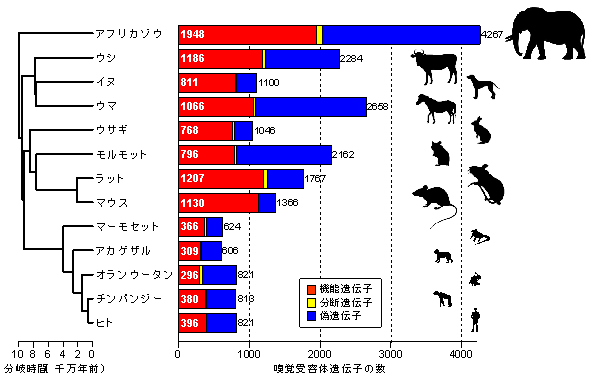
(Niimura Y, et al. 2014)
(雑誌名 Genome Research
論文タイトル “Extreme expansion of the olfactory receptor gene repertoire in African elephants and evolutionary dynamics of orthologous gene groups in 13 placental mammals”
著者 Yoshihito Niimura, Atsushi Matsui, Kazushige Touhara)
から引用しています。
https://www.jst.go.jp/pr/announce/20140723/index.html
この論文では、ヒトの嗅覚受容体遺伝子(機能遺伝子)が396個であることが明らかにされています。ヒトの遺伝子総数は23000ですので、単純計算で1.7%が嗅覚受容体遺伝子となります。この値は1/50弱に相当し、遺伝子総数に対する嗅覚受容体遺伝子の数はかなり高い割合であることが理解できます。
偽遺伝子数は425個で遺伝子総数は821個になります。このときの割合は3.6%、全体の1/30強です。
これら嗅覚受容体遺伝子は、第20番染色体とY染色体を除く全ての染色体上にクラスターとして存在し、11番染色体上には40%の遺伝子が存在することが確認されています。
その意味は?
嗅覚受容体ならびに、嗅覚受容体発現に必要な遺伝子について書いてきました。遺伝子との関係などかなり情報量が多く、内容がまとめにくかったと思います。
論点は、嗅覚受容体を発現している遺伝子はヒトゲノムの遺伝子数の中でも非常に多いこと、です。
嗅覚という特殊な感覚は、視覚、聴覚、嗅覚、味覚、触覚の5つの感覚の中で、視覚や聴覚とともに生物が生きていくことに直結しています。動物は視覚や聴覚によってだけでなく、天敵の匂いを嗅覚によって識別して、逃走の必要性を判断します。また食べ物を探すとき、捕獲する動物の所在を匂いで判断します。見つけた食べ物が食べて良いものかどうか、有害でないかどうかは、嗅覚や味覚によって判断します。視覚を失った動物が自ら食べ物を探せなくなり多くが死に至るように、嗅覚を失ったり減弱した場合も、生命を維持することが著しく困難な状況に陥ります。この事実は哺乳動物だけでなく、嗅覚を有する生物全般に及びます。
長い進化の歴史において、生物における嗅覚の存在は相当重要な位置を占めてきました。
このことが、遺伝子において嗅覚受容体発現のための遺伝子が多く存在することの証ではないかと考えています。