視力、聴力は年齢とともに衰えます。
嗅覚に加齢はあるのでしょうか。
今回は嗅覚障害の原因とともに、嗅覚と年齢の関係についても書きました。
嗅覚の発生
ヒトの嗅上皮は、胎生4週に発生すると言われています。出生時にはヒトの嗅覚系はほとんど完成しています。
年齢と嗅覚
嗅覚は加齢変化を受けます。
ヒトの嗅覚は30歳代をピークに徐々に低下し、60歳代からは急激に低下していくと言われています。70歳代から急激に低下して80歳以上では75%に嗅覚障害が認められると報告されています。アメリカの有名な Beaver Dam Offspring Study では、嗅覚低下は3.8%に認められ、35歳以下は0.8%であったのに対し、65歳以上は13.9%と高い数値を示しています。日本国内においては、大規模な疫学調査は未だ行われていませんが、60歳台からは有意に嗅覚が低下することが複数の施設から報告されています。
嗅細胞の変化
一般に哺乳類では神経細胞は再生しません。
したがって神経細胞が傷害されると機能は不可逆的に低下したままです。
ところが嗅上皮においては、基底細胞の分裂によって絶えず新しい嗅細胞が再生されています。すなわち、嗅細胞は視細胞などと違って同一の神経細胞が終生存在を続けているのではなく、新しい細胞が次々に入れ替わる現象が起こっています。
この嗅細胞の再生(turn over)は、加齢に伴って低下します。加齢によって分化能を有する基底細胞が減少して、基底細胞から嗅細胞へと分化する割合が減少していきます。嗅細胞のターンオーバーが減少すると、嗅粘膜面積が縮小していきます。
一般に高齢者では、嗅粘膜に島状に呼吸上皮化生が起こっています。さらに嗅神経先端の嗅球でも、嗅細胞からの軸索投射が少ない糸球体が増加して、糸球体層の萎縮がみられます。
このような病理学的変化が、加齢による嗅覚低下を引き起こしているのだと考えられています。
嗅覚低下の原因は
嗅覚と年齢について考察する前に、まず嗅覚障害の原因について書きます。
以前にも書きましたが、嗅覚障害の原因として多いのは、
①鼻副鼻腔炎
②感冒後
③外傷性
の3つです。
これに、以下の原因が続きます。
④先天性嗅覚障害
⑤神経変性疾患
⑥加齢
① 鼻副鼻腔炎
多くの場合、慢性副鼻腔炎です。
持続する副鼻腔炎による嗅裂部の慢性炎症や分泌物の停滞によって、嗅上皮の炎症が起こり、嗅覚低下が起こります。(嗅粘膜性嗅覚障害)
高度のアレルギー性鼻炎や鼻中隔わん曲症などによって鼻腔通気が不良であったり、嗅裂が閉塞している場合は、鼻腔からの吸気が嗅裂に届かず、嗅覚低下が起こります。(気導性嗅覚障害)
慢性副鼻腔炎における手術後の嗅覚障害の改善については、50歳以上、鼻手術の既往、7年以上の罹病期間、好酸球性副鼻腔炎、喘息の合併、静脈性嗅覚検査陰性などが嗅覚予後の不良に関係すると報告されています。
嗅覚障害は、慢性副鼻腔炎の重症度や好酸球性か非好酸球性かの診断にも大きく左右されますが、条件が同じであるなら、「治療開始時の年齢」が嗅覚障害の程度やその改善率に影響を及ぼしていることは確実であり、今後の詳細な検討がなされるべきと考えられます。
② 感冒後
ウイルス性上気道炎(風邪)によってウイルス性嗅神経炎が起こった後の病態です。嗅神経細胞の炎症によって神経障害が起こり、嗅覚低下をきたします。
40歳台以降の女性に多く発症すると言われています。風邪が治癒した後、副鼻腔炎は改善しても嗅覚障害はなかなか改善せず、嗅覚が回復するのに1年以上かかることも多くみられます。40歳未満では1年後の嗅覚回復率が50%であるのに対して、70歳以上では回復率は7%であったとの報告があります。
③ 外傷性
頭部外傷(打撲)による嗅覚障害です。
外傷時の頭蓋内容(脳)の捻れ力による、鼻腔天蓋の篩板(しばん)(図1の3)においての嗅神経の軸索損傷の可能性が指摘されています。
嗅索の物理的引っ張りによって、嗅神経細胞から嗅球に至る神経線維の断裂が起こります。
神経線維の特性から、比較的若年層では神経再生の可能性があります。とくに小児では脳の可塑性が大きいため、予想外の回復がみられることがあります。
一方、成人以降では神経の可塑性が小さいため神経再生が期待できず、外傷性嗅覚障害の予後は一般に不良です。
多くの場合、全く匂いを感じない嗅覚脱失になります。
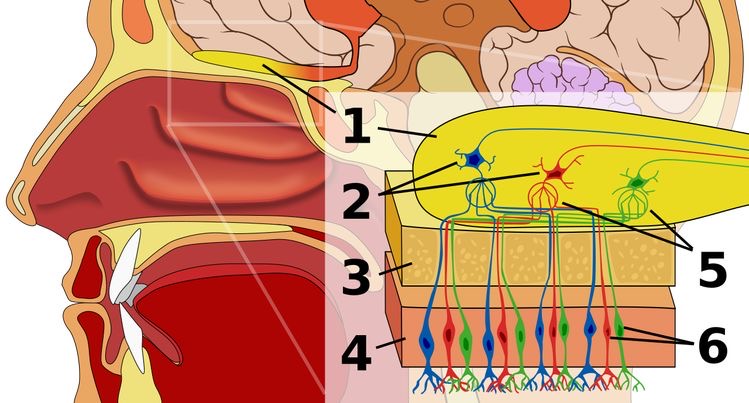
https://ja.m.wikipedia.org/wiki/%E5%97%85%E8%A6%9A
- 嗅球
- 僧帽細胞
- 篩板
- 嗅上皮
- 嗅糸球
- 嗅神経細胞
感冒後は、嗅神経細胞⑥のウイルス性神経障害が起こります。
外傷性は、篩板③の上部で嗅神経(嗅球)が捻れて嗅神経軸索(赤色🟥、青色🟦、緑色🟩)が断裂した状態です。
慢性副鼻腔炎では、嗅上皮④の慢性炎症を起こし、嗅粘膜障害による嗅覚障害を起こします。
慢性副鼻腔炎やアレルギー性鼻炎、鼻中隔わん曲症による慢性鼻閉があると、吸気が嗅上皮に到達しない「気導性嗅覚障害」が起こります。
④ 先天性
先天性の嗅覚障害がある患者さんは、「匂い」というものを知りません。匂いがあることもわからず、それが別段異常とも感じません。そのため、嗅覚障害以外の疾患の合併があれば、その診断時に発見されることがありますが、嗅覚障害のみでは自覚がないために診断が遅れるのが普通です。ご両親が「匂いに反応しない」と訴えて受診すれば診断可能になりますが、本人が匂いの概念がわからないため、家族や周囲からつよく指摘されないと本人に病識が生まれません。
先天性の嗅覚障害で受診する患者さんの年齢層は、10歳台前半から20歳台後半と報告されています。他の原因による嗅覚障害に比較すると受診は低年齢ですが、他の先天性疾患の多くが生後間もない時期に発見されるのと比較すると圧倒的に遅いと言えます。
Kallmann 症候群
代表的な先天性嗅覚障害は、Kallmann 症候群です。Kallmann はカルマンと読みます。先天性嗅覚障害に低ゴナドトロピン性性腺機能低下症の合併を認めます。
男性では停留睾丸、小陰茎、女性では思春期遅発がみられ、男女とも第2次性徴の欠如を認めます。
常染色体優性遺伝やX連鎖性劣勢遺伝、常染色体劣性遺伝をとり、男性にも女性にも起こります。
Kallmann 症候群では、嗅神経における嗅球の形成不全を伴い、嗅覚がありません。
Kallmann 症候群では、視床下部のLHRH(ゴナドトロピン放出ホルモン)分泌ニューロンの遺伝子欠損によって、LHRH(ゴナドトロピン放出ホルモン GnRH)が合成されません。
そのためLHRHによって下垂体から分泌される、第2次性徴をつかさどる役割をもったゴナドトロピン(LH, FSH)が分泌されません。
性腺刺激ホルモンであるLH, FSH が分泌されないため、男性ホルモンのテストステロン、女性ホルモンのエストロゲンが分泌されず、14-15歳頃になっても男女とも第2次性徴が起こりません。
成長ホルモンは正常であるため体の発達は正常で、第2次性徴発来の年齢まで気づかれないこともあります。また、低ゴナドトロピン性性腺機能低下症のために小児科医を受診していることもあります。
第2次性徴はゴナドトロピン製剤の投与によって発来し治療可能ですが、嗅覚障害は回復しません。(回復というより嗅覚という感覚が欠損しています。)
Kallmann 症候群では、KAL1遺伝子変異によって嗅神経の軸索伸長に必要な糖タンパクのanosmin-1合成がブロックされます。
anosmin-1欠損によって、嗅神経細胞から嗅球への神経線維の伸長が起こらず、嗅球の形成不全が起こることが知られています。
anosmin-1 タンパクは、LHRH ニューロンの生成にも必要なため、先に書いた視床下部でのLHRH分泌ニューロンの欠損も生じてくることがわかっています。
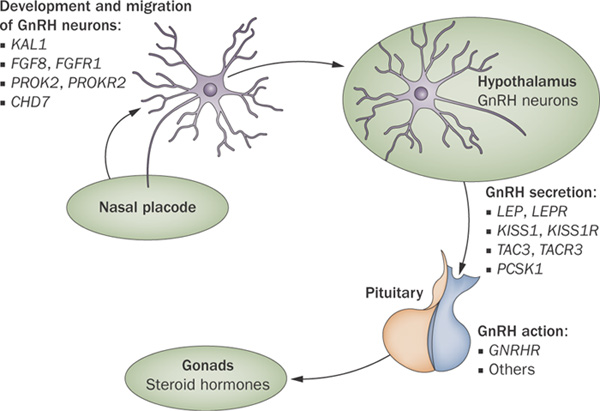
https://en.m.wikipedia.org/wiki/Kallmann_syndrome
遺伝子異常(anosmin-1欠損)によって、胎生期に鼻原基(nasal placode)からのGnRH neurons (LHRH neurons)の発生と遊走が起こらず、視床下部(Hypothalamus)においてLHRH ニューロン(GnRH neurons)が形成されません。
視床下部において分泌細胞がなくなるため、下垂体(Pituitary)からのゴナドトロピン(Gonads =LH, FSH)が分泌されなくなります。その結果、第2次性徴が起こりません。(図2)
Kallmann 症候群の遺伝形式はすこし複雑です。現在までに14個の責任遺伝子が同定されていますが、代表的な5つのKallmann 症候群の遺伝子は、FGFR1、FGF8、PROKR2、PROK2、KAL1です。頻度の高い遺伝子は、anosmin-1合成阻害が関与するKAL1(X連鎖性劣性遺伝)、
線維芽細胞増殖因子(Fibroblast growth factor, FGF)受容体1をコードしているFGFR1(常染色体優性遺伝)の2つです。
Kallmann 症候群の出生率は全世界で男性1万人に1人、日本国内では男性5万人に1人と言われています。女性は男性の1/5-1/6の出生率です。(25万-30万人に1人、国内)
比較的頻度の高い疾患ですが、先の条件のため出生直後に診断されることはほぼ皆無です。
頭部MRI検査で嗅球の形成不全が確認されます。
https://minds.jcqhc.or.jp/docs/gl_pdf/G0001102/4/Olfactory%20disturbance.pdf
(嗅覚障害診療ガイドライン 2017年 日本鼻科学会編)
(P16 図6 にKallmann 症候群の頭部MRI画像が掲載されています。ご覧ください。)
Kallmann 症候群の嗅覚障害は、嗅球の形成不全であるため、嗅覚障害分類の「中枢性」嗅覚障害に該当します。
嗅球体積は、幼児期から成人と大差ない数値を示すとする報告があり、一般に45歳未満で58 mm3 以上が正常範囲とされています。
Kallmann 症候群では、無嗅症のほかに、腎形成異常や難聴、口唇口蓋裂などを合併します。
Kallmann 症候群では、同じ遺伝子変異を有する家系内で嗅覚正常例も報告されていて、まだ解明されていない部分もあります。
CHARGE 症候群
もう1つ代表的な先天性嗅覚障害は、CHARGE症候群です。8番染色体上のCHD7遺伝子の変異により発症する多発奇形症候群と定義されます。出生児 2万人に1人に発症する希少疾患で、厚生労働省の指定難病に登録されています。
CHARGE症候群は、C(Coloboma, 網膜の部分欠損)、H(Heart defects, 心奇形)、A(Atresia of the choanae, 後鼻孔閉鎖)、R(Retardation of growth and/or development, 成長障害、発達遅滞)、G(Genital hypoplasia, 外陰部低形成)、E(Ear malformation or hearing loss, 耳奇形、難聴)を主症状とする疾患です。
CHARGE症候群は、CHD7遺伝子が全身の多くの臓器に発現しているため、嗅球や嗅上皮だけでなく、眼(視力障害)や内耳(難聴)、生命維持に必須の心疾患(心奇形)や呼吸器系の異常(後鼻孔閉鎖や口蓋裂)、下垂体(成長ホルモン低下)など多くの部位で発現するため、多系統の障害が起こるとされています。
特殊な先天性疾患のため、ここでは詳細は省略します。
⑤ 神経変性疾患(AD, PD)
アルツハイマー病(Alzheimer disease, AD)やパーキンソン病(Parkinson disease, PD)では、早期から嗅覚障害を生じることが知られています。
アルツハイマー病(AD)は65歳で7%、75歳で10%の有病率です。
パーキンソン病(PD)は40歳以上に好発し1000人に1人の有病率と報告されています。
アルツハイマー病(Alzheimer disease, AD)
アルツハイマー病(Alzheimer disease, AD)は、通常ゆっくりと始まり徐々に進行する神経変性疾患です。認知症の60-70%の原因となっています。
アルツハイマー病(AD)は、世界で約5,000万人いると報告されており、多くは65歳以上で発症しますが、10%未満が早期発症型で30代から60代前半に発症します。
アルツハイマー病(AD)は65歳で7%、75歳で10%の有病率で男性よりも女性の方が多くなっています。
アルツハイマー病は、早発型ADと晩期発症型ADがあります。
ADは遺伝子変異が原因です。
早発型ADは家族性で、原因は第21染色体上のアミロイド前駆体蛋白質 (APP) 遺伝子、第14染色体上のプレセニリン1遺伝子 (PSEN1) 、第1染色体上のプレセニリン2遺伝子 (PSEN2) です。早発型(家族性)アルツハイマー病で最も多いのはPSEN1遺伝子変異です。
晩期発症型ADは、第19染色体のアポリポタンパクE(ApoE)の多型のε4対立遺伝子が発症促進因子であることが確認されています。
晩発型ADは、遺伝子変異以外に発症危険因子が多く存在し、脳血管障害、2型糖尿病、高血圧、喫煙、肥満、頭部外傷などが報告されています。
ADの病理学的特徴は、神経細胞の変性消失とそれに伴う大脳萎縮、アミロイドβ蛋白(Aβ)の沈着、神経原線維性変化(neurofibrillary tangle, NFT)=微小管結合タンパク(タウ)の多発です。
(tangleは”もつれ”の意味です。)
アミロイド前駆体タンパク質(amyloid precursor protein, APP)またはアミロイドβ前駆体タンパク質(AβPP)は、多くの神経細胞のシナプスに濃縮して発現する膜タンパク質です。APPの働きは主としてシナプス形成と修復です。APPが分解されてアミロイドβ(Aβ)となります。
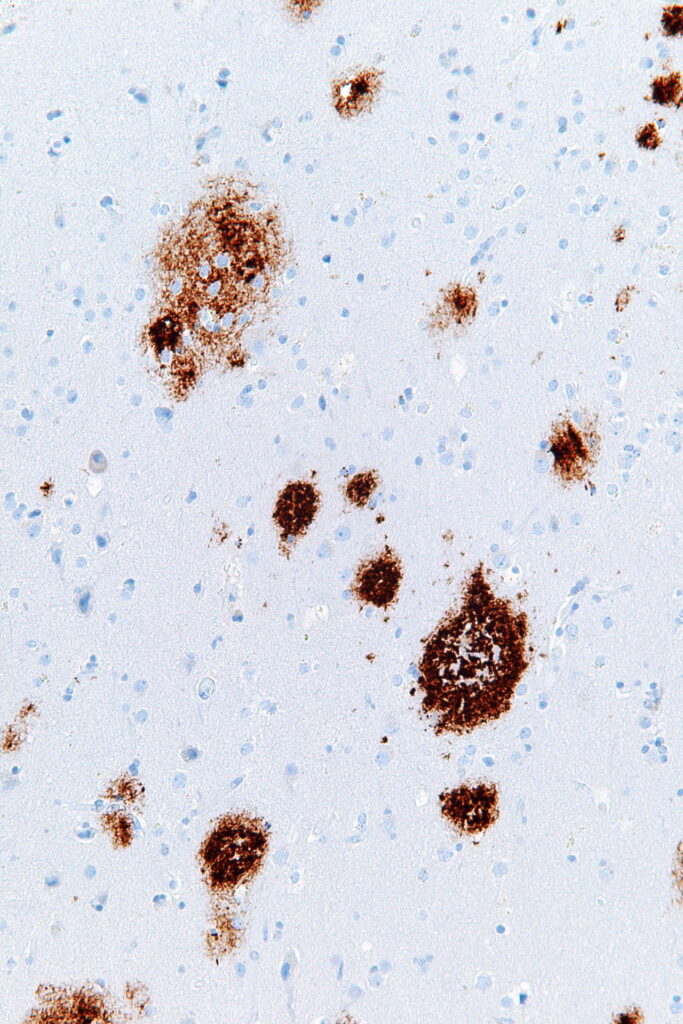
アミロイドβ(Aβ)の蓄積
https://ja.m.wikipedia.org/wiki/%E8%80%81%E4%BA%BA%E6%96%91
Aβは凝集してオリゴマー(低分子重合体)を形成しますが、この時タンパク質が誤って折り畳まれると(ミスフォールディング)、神経毒性を有するようになり、神経変性の引き金になると考えられています。
(正常フォールディング)
https://ja.m.wikipedia.org/wiki/%E3%82%A2%E3%83%9F%E3%83%AD%E3%82%A4%E3%83%89%CE%B2
Aβ沈着はアルツハイマー病の病理所見に多数必発です。
タウ(τ)タンパク質は、微小管結合タンパク質(microtubule-associated protein, MAP) です。
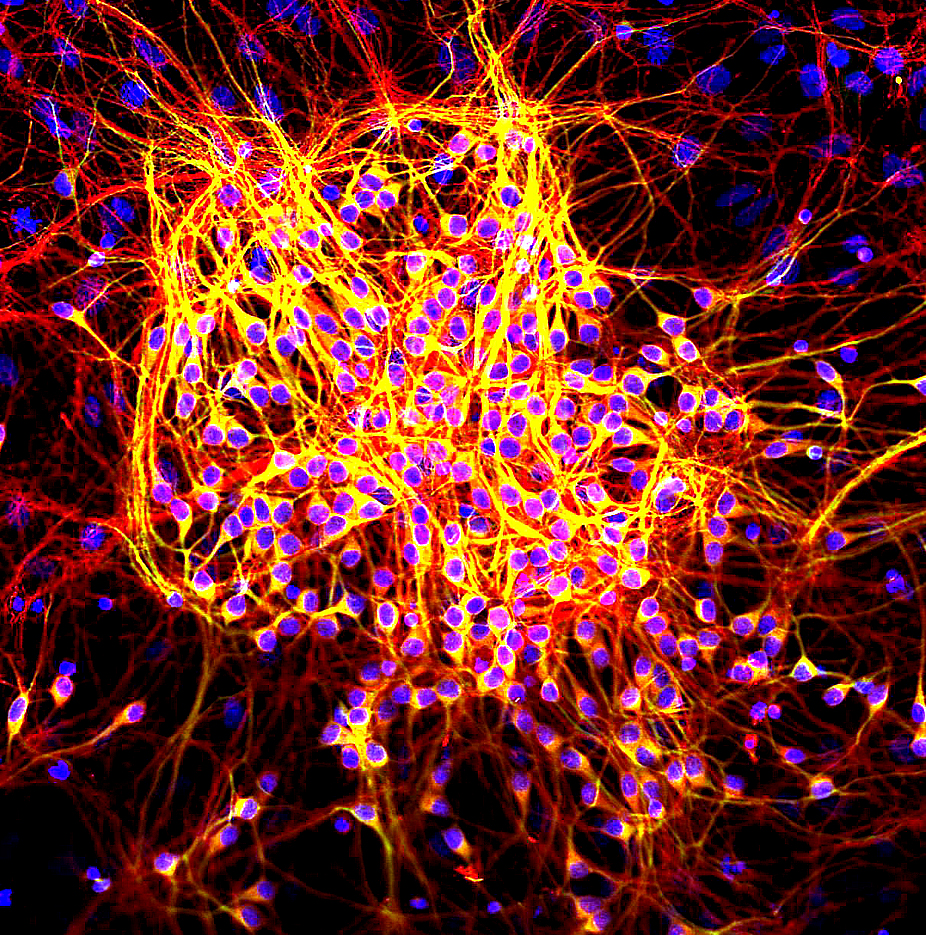
核が青色で染色されている培養神経細胞
https://ja.m.wikipedia.org/wiki/%E3%82%BF%E3%82%A6%E3%82%BF%E3%83%B3%E3%83%91%E3%82%AF%E8%B3%AA
τタンパク質はほとんど神経細胞に見られ、軸索の微小管の安定結合を担っています。
MAP2は樹状突起と細胞体で、タウ(τ)は樹状突起、細胞体、軸索で観察されます。そのため、軸索は赤く、樹状突起と細胞体は赤と緑のシグナルが重なって黄色く見えています。(写真1)
https://ja.m.wikipedia.org/wiki/%E5%BE%AE%E5%B0%8F%E7%AE%A1
タウはリン酸化されると微小管構造を破壊します。過剰にリン酸化されたタウが神経細胞に蓄積すると、神経原線維変性 (neurofibrillary degeneration) を引き起こします。タウは細胞内で神経毒性をもち、微小管の破壊や細胞質の機能に傷害を与えたり、神経細胞の軸索輸送に干渉して細胞死をもたらします。
神経原線維変化 (neurofibrillary tangle, NFT) はタウタンパク質が互いに結合した凝集体です。NFTは、神経細胞へ分配される必須栄養素を遮断して細胞死を引き起こします。
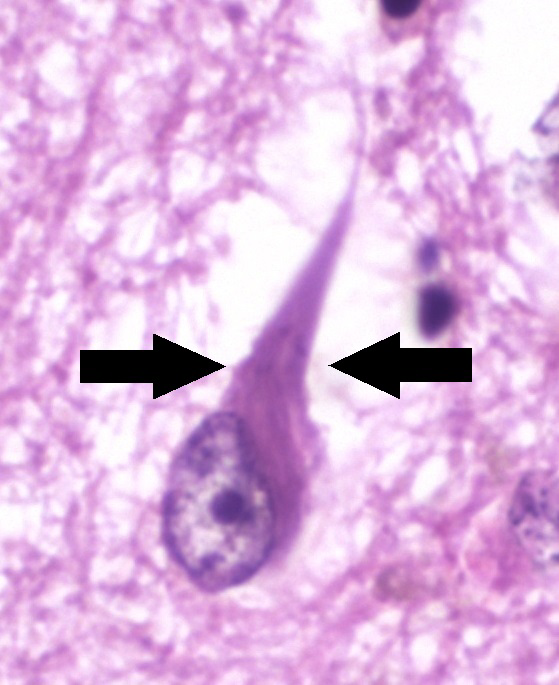
https://en.m.wikipedia.org/wiki/Neurofibrillary_tangle
写真2では、神経原線維の捻れ(tangle)が観察されています。
ADの嗅覚障害
ADの患者さんは病初期から嗅覚障害を認め、進行性ですが、患者さんの90%は嗅覚障害を自覚していないと言われています。
ADの多くは認知症に合併しますが、嗅覚障害はADへの進行のリスク因子になります。
パーキンソン病(Parkinson disease, PD)
パーキンソン病は、手のふるえや動作、歩行の困難などの運動障害を示す、進行性の神経変性疾患です。進行すると自力歩行が困難となり、車椅子や寝たきりになる場合があります。
40歳以上の中高年の発症が多く、特に65歳以上の割合が高いと言われています。
日本における有病率は10万人当たり100〜150人、欧米では10万人当たり300人と言われています。
『神経系疾患マニュアル』(1886年)に
記載されたパーキンソン病のイラスト
https://ja.m.wikipedia.org/wiki/%E3%83%91%E3%83%BC%E3%82%AD%E3%83%B3%E3%82%BD%E3%83%B3%E7%97%85
90-95%が家族歴がありませんが、近年いくつかの変異遺伝子が同定されています。
神経変性の原因は、頭部外傷、低酸素脳症、薬剤性などが確認されていますが、未だ多くは不明です。
パーキンソン病(PD)の症状は、運動症状と非運動症状に分けられます。
①安静時振戦(resting tremor)
②アキネジア(akinesia、無動)寡動
(bradykinesia)
③筋強剛(筋固縮) (rigidity)
④姿勢保持反射障害 (postural instability)
が、パーキンソン病の特徴的な4つの運動症状です。
非運動症状は、自律神経症状と精神症状があります。自律神経症状は、流涎、嘔吐、便秘、構音・嚥下障害、起立性低血圧、発汗過多、排尿障害、勃起不全などがあります。
精神症状には、感情鈍麻、うつ症状、幻視、幻聴、認知障害などがあります。
パーキンソン病(PD)の病態は、中脳黒質に緻密質おけるドーパミン分泌細胞の減少が線条体においてドーパミン不足とアセチルコリン増加を引き起こすことを特徴とする神経変性疾患で、ドーパミン分泌細胞の変性がその本質です。
PDの病理学的な変化は、
①肉眼的に、中脳の黒質、青斑核の色素脱失がみられる
②組織学的に、黒質や青斑、迷走神経背側核、視床下部、交感神経節などに神経細胞脱落が生じており、典型的な例では、残存神経細胞やその突起の一部にレビー小体(Lewy body)という特徴的な封入体が認められる。
の特徴を有しています。
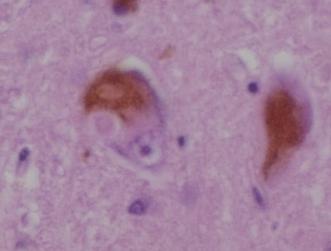
ピンク色の同心円状の部分
https://ja.m.wikipedia.org/wiki/%E3%83%AC%E3%83%93%E3%83%BC%E5%B0%8F%E4%BD%93
褐色の部分はメラニン色素で、その直下の薄いピンク色をした同心円状の構造物がレビー小体です。(写真3)
レビー小体(Lewy body, LB)は、中枢および末梢の神経細胞内部に出現する、異常な円形状の好酸性細胞質封入体です。
レビー小体(LB)は、染色すると芯(core)は濃く染まり周辺部(halo)は明るく見えます。
レビー小体(LB)には、リン酸化α-シヌクレインの異常な蓄積が認められます。α-シヌクレイン以外に、α-シヌクレインに結合するユビキチン・ニューロフィラメントタンパク質・α-Bクリスタリンなどのタンパク質から構成されます。
LBは、ドーパミン、ノルアドレナリン、セロトニン、アセチルコリンを分泌する神経細胞に好発します。レビー小体は自律神経節など末梢にも蓄積することがわかってきましたが、詳しい出現機序は未だよく解明されていません。
レビー小体が関与する疾患には、パーキンソン病(PD)、レビー小体型認知症(DLB)があります。
パーキンソン病では、中脳の黒質緻密質のドーパミン神経が変性脱落したところにレビー小体ができます。
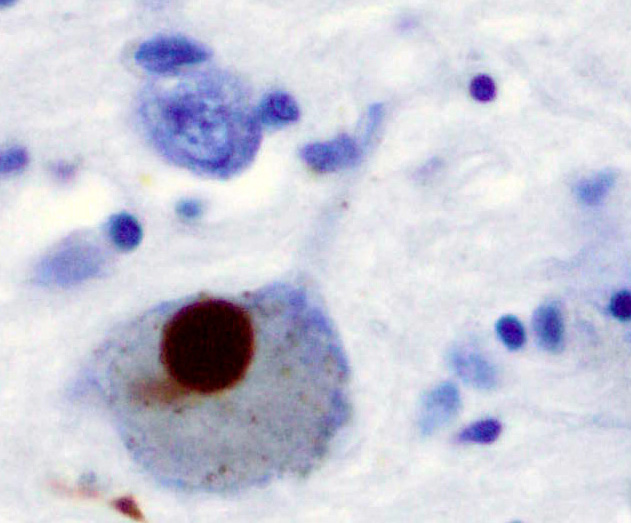
α-シヌクレイン陽性染色
(パーキンソン病)
レビー小体がα-シヌクレイン染色でつよく染まっています。(写真4)
α-シヌクレインが大量に蓄積していることが確認されます。
α-シヌクレインは主として神経細胞内に存在する機能不明のタンパク質です。細胞質中のタンパク質の約1%にのぼります。
α-シヌクレインは細胞質のミトコンドリア内部に局在しています。嗅球、海馬、線条体、黒質、視床では細胞質・ミトコンドリア内部にともに高濃度のα-シヌクレインが存在します。
一方大脳皮質と小脳では細胞質には豊富に存在しますが、ミトコンドリア内部にはほとんど存在しません。
α-シヌクレインがミトコンドリア内膜上に局在していること、そして濃度依存的にミトコンドリア呼吸鎖の複合体I(図6)に対して阻害的に作用することがわかっています。
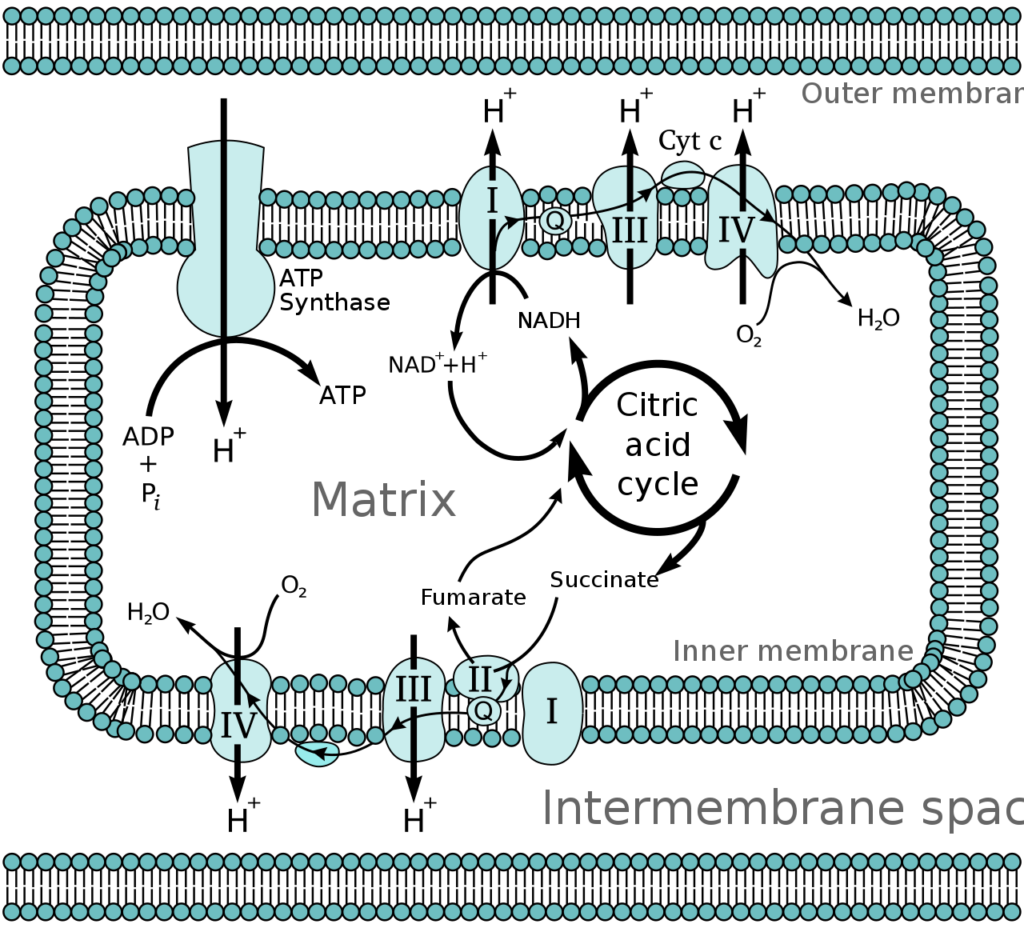
電子伝達系とTCAサイクル
https://ja.m.wikipedia.org/wiki/%E3%83%9F%E3%83%88%E3%82%B3%E3%83%B3%E3%83%89%E3%83%AA%E3%82%A2
ミトコンドリア内膜の電子伝達系では、ATP産生が行われています。ミトコンドリア内膜でα-シヌクレイン発現の量が増えると、ミトコンドリア呼吸鎖(電子伝達系)をつよく阻害します。
α-シヌクレイン蓄積はミトコンドリア呼吸鎖の機能低下を起こしてミトコンドリア機能を低下させ、細胞の傷害やアポトーシス(細胞死)を引き起こすことになると考えられています。
PDの嗅覚障害
パーキンソン病(PD)の患者さんの90%以上が嗅覚脱失を示すと報告されています。
PDの嗅覚障害の特徴は、
①女性より男性に多いこと、②90%以上で両側性高度であること、③病悩期間とともに増悪すること、④PDの運動症状の出現の数年前に生じること、⑤遺伝性PDでは嗅覚障害を認めるが薬剤性PDでは嗅覚障害を認めないこと、などがあります。
嗅覚障害はPD発症のリスク因子になることが知られています。
AD, PDの嗅覚障害の特徴として、嗅覚検査時の「検知閾値」と「認知閾値」に、乖離(かいり)がみられることが指摘されています。
「何かにおうけど、何の匂いかわからない」状態です。
これは高齢者の嗅覚障害でしばしば経験することです。
AD, PDの神経変性
AD、PDともに神経変性が嗅覚伝導路に生じることが原因で嗅覚障害を起こすと言われています。ADでは嗅内野皮質において最初に病理学的変化が起こり、嗅核前核においても神経原線維変化が起こります。PDは病初期から嗅球に病理学的変化が出現することが確認されています。
PDでは、α-シヌクレインの蓄積(レビー小体の発現)が嗅球、延髄から始まり、徐々に上行して中脳に至り、最終的には大脳皮質に達するという仮説が現在、ドイツの病理学者であるハイコ・ブラークにより提唱されています。(ブラークの仮説)
PDでは発症4年前からの嗅覚低下が報告されており、PDの早期診断に嗅覚低下が一助になる可能性を示唆しています。
AD, PDの嗅覚障害を比較すると、PDの方が早期から嗅覚障害を起こしてくると言えるかもしれません。
⑥ 加齢
嗅覚障害の最後の原因としてあげられるのが、加齢による変化です。
もともと加齢(aging)とは、老化と同義です。
老化とは何か?
老化の仮説には現在、プログラム説、活性酸素説、テロメア説、遺伝子修復エラー説、分子間架橋説、免疫機能低下説、ホルモン低下説などがあり、議論されています。
ヒトの細胞の分裂限界(Population doubling level, PDL)(ヘイフリック限界)は50で、最大寿命は約120年、ウサギではPDL20で最大寿命は約10年、ラットではPDL15で最大寿命は約3年と言われています。
PDLと最大寿命は直線的な関係がみられることが知られています。
生体組織から取り出した細胞を in vitro で培養すると、細胞分裂の回数に制限があることがわかりました。その原因の1つは、染色体末端のテロメア構造が短くなったためとされています。
テロメアを伸長する酵素にテロメラーゼがあり、テロメラーゼの働きによってがん細胞などは、細胞分裂の回数の制限がなくなると考えられています。
テロメア説
テロメアとは、染色体の末端にある構造(塩基配列)で、染色体末端を保護する機能を持っています。テロメアが失われると、染色体融合という構造異常を誘発します。
テロメラーゼ
テロメラーゼ (telomerase)は、テロメアの特異的反復塩基配列を伸長させる酵素のことです。
テロメア伸長のテンプレート(鋳型)となるRNA構成要素と逆転写酵素活性を持つ触媒サブユニットおよびその他の制御サブユニットによって構成されています。
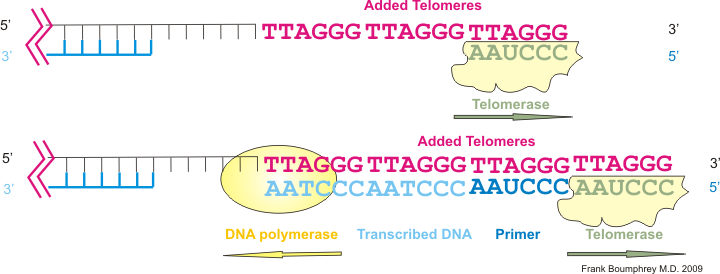
https://ja.m.wikipedia.org/wiki/%E3%83%86%E3%83%AD%E3%83%A1%E3%83%A9%E3%83%BC%E3%82%BC
ヒトのテロメラーゼは、DNA末端の3′ 側に6塩基配列 「TTAGGG」を付加します。(図7上)
付加された配列をテンプレート(鋳型)としてDNAポリメラーゼが相補鎖を合成します。(図7下)
このようにしてDNAが「複製のたびに短縮していく」のを防ぎます。
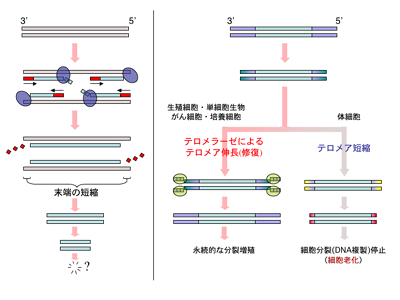
https://ja.m.wikipedia.org/wiki/%E3%83%86%E3%83%AD%E3%83%A1%E3%83%A9%E3%83%BC%E3%82%BC
DNAはDNAポリメラーゼ(左側 薄紫色🟣)によって複製されますが、最末端のプライマー(赤線🟥)部分は複製されません。このため複製のたびにDNAは短縮します。
これが「末端複製問題」です。(図8 左側)
生殖細胞やガン細胞ではテロメラーゼによって末端部分の複製が行われます。(黄緑色🟩)テロメラーゼ活性がない体細胞では分裂ごとに短縮がおこり、一定以上短くなると分裂を停止し細胞老化が起こります。(図8 右側)
テロメラーゼは、ヒトでは生殖細胞・幹細胞・がん細胞などでの活性が認められており、それらの細胞が分裂を継続できるようにコントロールに関与しています。
テロメラーゼ活性が低い細胞は、一般に細胞分裂ごとにテロメアの短縮が進み、やがて「ヘイフリック限界」と呼ばれる細胞分裂の停止が起きます。
細胞老化
ヘイフリック限界(Hayflick limit)とは、細胞の分裂回数の限界のことです。ヒト体細胞が決められた分裂可能回数を持っていて、その回数に達すると細胞は分裂を中止します。細胞老化という状態です。
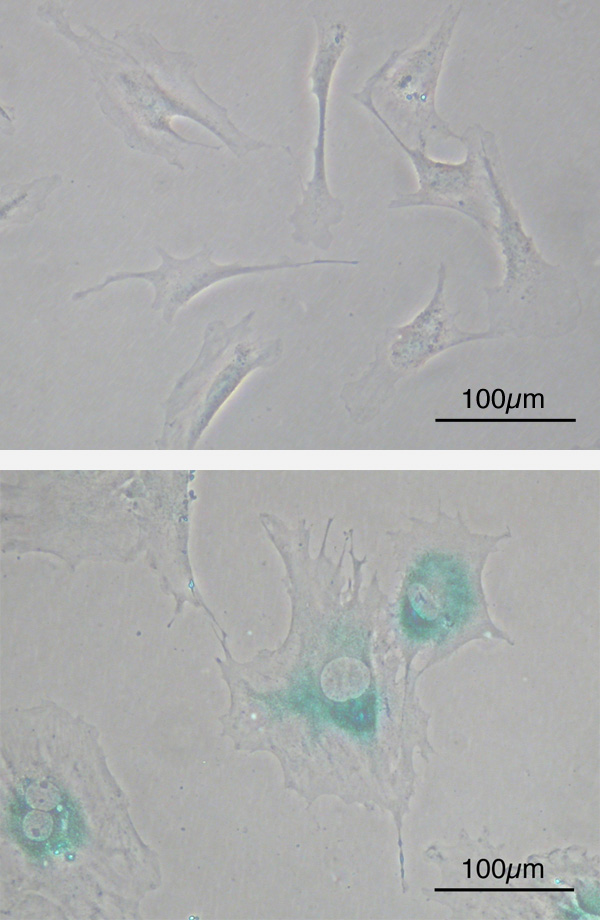
細胞分裂8回目(下)
下は細胞老化の状態
線維芽細胞(マウス)
https://ja.m.wikipedia.org/wiki/%E7%B4%B0%E8%83%9E%E8%80%81%E5%8C%96
老化前の線維芽細胞は紡錘形の細胞ですが(写真5上)、老化後には平坦で大きな形態の細胞になり、細胞分裂を起こさなくなります。(写真5下)
細胞老化関連βガラクトシダーゼ(senescence-associated β-galactosidase, SABG 写真5下 青色の部分)などの老もマーカー分子の発現も認められます。
細胞老化の多くの原因は、放射線や酸化ストレスなどのDNA損傷によって誘導されます。DNA損傷によって細胞のがん化が起こる前に自己防御の機構が働いて細胞が分裂を停止するとも言えます。細胞老化した細胞は、不可逆的細胞老化の状態か、やがて細胞死(アポトーシス)が起こります。
これが老化の本態と考えられています。
高齢者の嗅覚障害
高齢者の嗅覚障害の多くは加齢によるものと考えられています。
嗅覚は男性では60歳を、女性では70歳を超えると有意に低下しはじめ、男女とも80歳以上では50%以上が何らかの嗅覚障害を有しています。
高齢者では基礎疾患をもつことも多く、その薬物治療を受けていることも多いため、高齢者の嗅覚障害が純粋に加齢による変化であるのか、または基礎疾患に起因するものであるのかを明確に区別することは難しいと思われます。
基礎疾患
例えば、糖尿病治療歴が20年に及ぶ80歳の高齢者が嗅覚障害を訴えるとき、その嗅覚障害が糖尿病による微小血管障害を含む糖尿病の合併症としての嗅覚障害なのか、または80歳という年齢による嗅覚障害なのかは、完全に区別することが困難です。
また、薬剤を何種類も定期的に服用している高齢者も多く、薬剤性の嗅覚障害の可能性も常に考慮されるべきです。
神経変性疾患と見分ける
さらに、先に書きました神経変性疾患、アルツハイマー病(AD)、パーキンソン病(PD)なども高齢になるほど発病しやすくなる事実があり、発症前からの嗅覚障害を訴えるPDなどでは、加齢による嗅覚障害との鑑別診断は、後日経過を観察して初めて可能になるとの矛盾点が含まれます。
これら神経変性疾患(AD, PD)の嗅覚障害については、本人の嗅覚障害の自覚や訴えにも、その正確性や再現性に一定の不確定要素が入り込むため、嗅覚障害の診断をさらに困難なものにしています。
加齢による嗅覚障害として…
純粋な「加齢による」嗅覚障害は、先に書いた “細胞老化” を基準に考えなければなりません。しかしながら現在の条件では、年齢以外のすべての要素を除外した嗅覚の生理的変化を追うことが困難であるため、便宜的に「基礎疾患による嗅覚障害と考えられる場合」を除いて、単純に年齢での嗅覚機能の変化を観察記録する以外にありません。
以下、一般的に年齢の変化にともなって発生してくる機能的、形態的な変化を加齢による変化と呼ぶことにします。
嗅上皮の再生
嗅神経細胞は、1つの細胞が終生維持されているのではありません。嗅神経細胞は次々に新しい細胞に入れ替わっています。
何らかの原因で嗅神経細胞が消失すると、基底細胞が分裂、分化して成熟した新しい嗅神経細胞になります。これは上皮細胞の再生(ターンオーバー)と同じです。
再生力と加齢
この嗅神経細胞の再生は、加齢による影響を受けます。
若いときには基底細胞の多くが嗅神経細胞に成熟していた過程が、加齢にともなって、成熟した嗅神経細胞になるまでに多くの基底細胞が脱落するようになります。さらに、嗅神経細胞も新しい細胞とのターンオーバーの間隔が長くなり、同じ嗅神経細胞が脱落せずに長く機能を維持するようになります。
すなわち、嗅神経細胞の再生力が低下して新しく作られなくなるために、古い嗅神経細胞が”頑張って”長く働くようになるのです。
加齢によって嗅神経の再生力が低下する理由として、現在、酸化ストレスとの関与が研究されています。
酸化ストレス
酸化ストレスとは、「生体内の酸化還元のバランスが乱れて、過酸化物やフリーラジカルが産生され、タンパク質、脂質、DNAが障害されて、細胞障害が起こること」をいいます。
リポフスチン(lipofuscin)は過酸化脂質の1つで、細胞質内の不飽和脂肪酸が過酸化反応を受けることによって細胞内に形成される色素です。加齢性色素とも呼ばれ、老齢個体の心筋線維、肝細胞、腎臓、副腎、神経細胞に沈着します。近年、このリポフスチンが嗅上皮の支持細胞近くに発現しているとの報告がなされており、酸化ストレスの蓄積が嗅神経の老化に関係していることが示唆されています。
エストロゲン
感冒後嗅覚障害は、閉経後の女性に多く発症します。嗅上皮の支持細胞、嗅神経細胞には、エストロゲン受容体が発現しており、加齢(閉経)によるエストロゲンの欠乏が、嗅神経細胞の恒常性を失わせているとの指摘がなされています。
形態的には?
嗅上皮は、生後間もなくから少しずつ薄くなり、嗅上皮の特徴的な3層構造も少しずつ乱れてきます。
嗅上皮は加齢とともに、厚さも面積も減少していきます。そして徐々に呼吸上皮へと変性(化生)が起こります。(呼吸上皮化生)
嗅上皮が斑(まだら)状に脱落する様子は、patchy appearance と呼ばれています。
嗅上皮の老化とは?
以上より嗅上皮の老化は、①嗅上皮の再性能の低下と②嗅上皮の組織学的変化によって、嗅上皮の萎縮を生じた状態と言えます。
嗅球から嗅皮質へ
嗅球は嗅覚の1次中枢です。
嗅神経からの軸索が嗅球の糸球体に収束して、僧帽細胞と傍糸球体細胞、房飾細胞、顆粒細胞などとの間に、嗅覚ニューロンの”マイクロサーキット”を形成しています。
嗅球から嗅皮質への出力は、僧帽細胞と房飾細胞が行なっています。僧帽細胞、房飾細胞の神経軸索は束になり、嗅球の後方外側で外側嗅索(lateral olfactory tract)となって嗅皮質へと投射されています。
嗅皮質は、
①前嗅核(anterior olfactory nucleus )、②嗅結節(olfactory tubercle)、③梨状皮質(piriform cortex)、④扁桃体皮質核(cortical amygdala)、⑤嗅内皮質(entorhinal cortex)
などから構成されています。
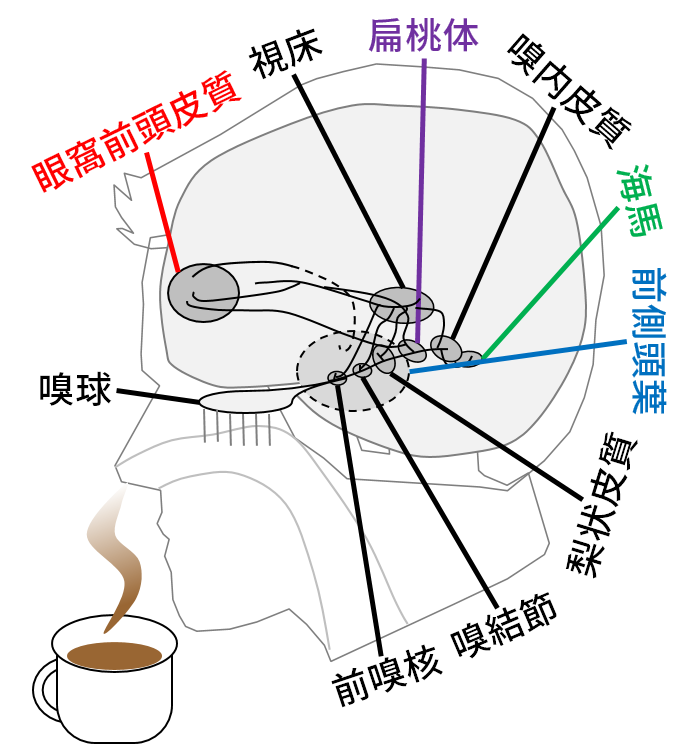
https://www.artsci.kyushu-u.ac.jp/~okamoto/lab-content.html
(九州大学 岡本剛研究室 脳機能*学
“においの脳科学研究” より引用しています)
最大の領域は、③梨状皮質(piriform cortex)であり、ここには僧帽細胞からの入力が最も多く投射されています。
このように嗅球は、いわば嗅神経線維のネットワークが収束している部位です。
嗅球、嗅神経の加齢は?
嗅球の糸球体層においても、加齢によって糸球体層の萎縮が見られると報告されています。
アルツハイマー病(AD)では、嗅内皮質において最初に病理学的変化が出現するため、早期に嗅覚障害を発症すると報告されています。
パーキンソン病(PD)では、嗅球と前嗅核がレビー小体(Lewy Body)の好発部位であることが報告されており、嗅球からPDの病理学的変化が始まるとの仮説が提唱されています。
事実、PDではPD発症の4年前から嗅覚障害が発現するとの報告があります。
AD, PDと加齢による嗅覚障害
AD, PDの病理学的変化による嗅覚障害は、加齢に伴う嗅覚障害とは厳密には鑑別されなければなりません。しかしながら、AD, PDの多くが若年発症例を除いては、嗅覚の加齢変化が始まる時期と重なってきます。
このため高齢者が嗅覚障害を訴えたとき、それが純粋に加齢による嗅覚障害であるのか、AD, PDの初期症状または前駆症状であるのかを、正確に診断するのは非常に困難をともなうと思われます。
数年が経過して初めて、結論からAD, PDの症状であったかどうかが判明します。
さらには、AD, PDによる嗅覚障害と診断される例の中にも、加齢に伴う病理変化があわせて進行していることが想像できます。
老人性難聴のように、加齢による難聴が他の原因によらないことがある程度明確にわかる場合は、加齢による変化が明確になりやすいと言えます。
反面、嗅覚という特殊な感覚には幾つもの複合する因子が関与しているため、その原因を正確に捉えることの難しさが浮き彫りになります。
加齢というもの
高齢者にとっての嗅覚
高齢者にとって嗅覚機能の維持は、食中毒の回避、ガス漏れの検知、その他生命に危険が及ぶ事態を早期に発見し避難することの必要性から、非常に重要な課題であると言えます。
嗅覚のアンチエイジング
一般的なアンチエイジング、リスクファクターの回避、神経変性疾患の早期発見、食の楽しみ方、喫煙や過度のアルコールの回避、週1回程度の定期的な運動、嗅覚トレーニングなどは、嗅覚機能の維持に正の効果をもたらすことが確認されています。
超高齢社会を迎えている世界、その最先端に位置すると言われている日本。今後、高齢化社会において、嗅覚は、視覚や聴覚とともに生活のQOLに深くかかわる重要な機能しとして認識されることでしょう。
今後研究が進めば、さらに嗅覚のアンチエイジングに有効な手段がわかってくると思います。いつか、嗅覚が全く衰えない、または衰えた、失った嗅覚を取り戻す方法が開発されるかもしれません。今後の研究成果が待たれます。
純粋な老化は?
ヒトは歳をとります。
視力、聴力など感覚器は加齢とともにその鋭敏さを失い、体内の臓器も年齢による病理変化を受けます。
嗅覚は、視力、聴力と同じ脳神経によってコントロールされていますが、脳神経細胞の老化の機構に視力や聴力とはすこし違う特徴をもっているようです。嗅覚の老化には、脳神経細胞の中でも唯一再生力を有している嗅神経細胞の特性が大きく関わっている可能性があります。さらにアルツハイマー病やパーキンソン病などの神経変性疾患による病理組織変化が合併している可能性が常にあり、純粋な細胞老化との区別が非常に困難です。
したがって、純粋な嗅覚の加齢変化については検討が難しい側面があります。
最後に
脳の大脳辺縁系は、ヒトの感情をコントロールする脳幹のもっとも原始的な部分です。嗅覚はこの大脳辺縁系と密接に繋がっており、そのため、匂いは過去の記憶や感情と深く繋がっています。
遥か昔、生物が誕生した瞬間から、匂いで食べ物を探し、食べれるかどうか匂いを嗅ぎ、過去に食べたことがあるかを思い出し、天敵の動物の匂いを感知し、匂いで敵味方を区別して、危険な匂いや環境の変化をいち早く察知して、生物が生き残っていくために、嗅覚は最も重要な感覚の1つでした。
それは、現代の進化したヒトにおいても全く同じ機能が残されています。
美味しそうな食べものの匂いで食欲がそそられたり、花の匂いや心地よい香りでで幸せな気分になったりするだけでなく、腐った食べ物を、ガス漏れを、火事の焦げ臭い匂いを、瞬時に教えてくれる体の防衛反応でもあるからです。

(イメージです)